
Back Kovalente binding Afrikaans Enlace covalent AN رابطة تساهمية Arabic Kovalent əlaqə Azerbaijani Кавалентная сувязь Byelorussian Ковалентна връзка Bulgarian সমযোজী বন্ধন Bengali/Bangla Kovalentna veza BS Enllaç covalent Catalan Gê̤ṳng-gá-giông CDO
| Enllaz covalente | |
|---|---|
| enllaz químicu | |
 | |
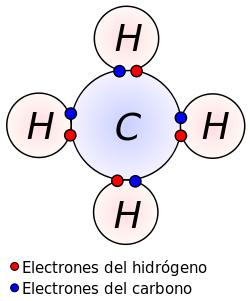
Un enllaz covalente ente dos átomos produzse cuando estos átomos xúnense, p'algamar l'octeto estable, compartiendo electrones del últimu nivel[1] (sacante'l hidróxenu qu'algama la estabilidá cuando tien 2 electrones). La diferencia d'electronegatividá ente los átomos nun ye lo suficientemente grande como por que se produza una unión de tipu iónica. Por que un enllaz covalente xenérese ye necesariu que la diferencia de electronegatividá ente átomos seya menor a 1,7.[2]
D'esta forma, los dos átomos comparten unu o más Par d'electrones pares electrónicos nun nuevu tipu d'orbital, denomináu orbital molecular. Los enllaces covalentes producir ente átomos d'un mesmu elementu non metal, ente distintos non metales y ente un non metal y l'hidróxenu.[3][4]
Cuando átomos distintos de non metales xunir nuna forma covalente, unu d'ellos va resultar más electronegativu que l'otru, polo que va tender a atraer la nube electrónica del enllaz escontra'l so nucleu, xenerando un dipolo llétricu.[5] Esta polarización dexa que les molécules del mesmu compuestu atraer ente sigo por fuercies electrostáticas de distinta intensidá.
Otra manera, cuando átomos d'un mesmu elementu non metálicu xúnense covalentemente, la so diferencia de electronegatividá ye cero y nun se crean dipolos. Les molécules ente sigo tienen práuticamente una atraición nula.
En resume, nun enllaz iónicu, produzse la tresferencia d'electrones d'un átomu a otru y nel enllaz covalente, los electrones d'enllaz son compartíos por dambos átomos. Nel enllaz covalente, los dos átomos non metálicos comparten unu o más electrones, esto ye, xúnense al traviés de los sos electrones nel postreru orbital, que depende del númberu atómicu en cuestión. Ente los dos átomos pueden compartise unu, dos o trés pares d'electrones, lo cual va dar llugar a la formación d'un enllaz simple, doble o triple respeutivamente. Na estructura de Lewis, estos enllaces pueden representase per una pequeñu llinia ente los átomos.
- ↑ Enllaz covalente en Google Books
- ↑ Quimica 2 (en castellanu). Ediciones Estragal. ISBN 9789685607209. Consultáu'l 2018-02-02.
- ↑ Picazo, Susana María López (2009). elementu+non+metal+y+ente+distintos+elementos+non+metales&hl=es&sa=X&ved=0ahUKEwjT5rSa2IfZAhWR6lMKHbtcC84Q6AEIJzAA#v=onepage&q=covalente%20mesmu%20elementu%20non%20metal%20y%20ente%20distintos%20elementos%20non%20metales&f=false Química. Pruebes d'accesu a la universidá pa mayores de 25 años (en castellanu). Cultivalibros. ISBN 9788499231099. Consultáu'l 2018-02-02.
- ↑ en+una forma covalente&hl=es&sa=X&ved=0ahUKEwjv6K7H2IfZAhVSnRQKHcFzAOUQ6AEILDAB#v=onepage&q=non%20metales%20se%20xunen%20en%20una%20forma%20covalente&f=false Química II Segundu Semestre Tacaná (en castellanu). IGER. ISBN 9789929804623. Consultáu'l 2018-02-02.
- ↑ (2004) nube+electr%C3%B3nica+del enllaz+escontra+el so+n%C3%BAcleo&hl=es&sa=X&ved=0ahUKEwjoxom22YfZAhUJShQKHbRdApwQ6AEIJzAA#v=onepage&q=atraer%20la%20nube%20electr%C3%B3nica%20d'el%20enllaz%20escontra%20el so%20n%C3%BAcleo&f=false La Quimica en Les tos Manes (en castellanu). UNAM. ISBN 9789703212231. Consultáu'l 2018-02-02.